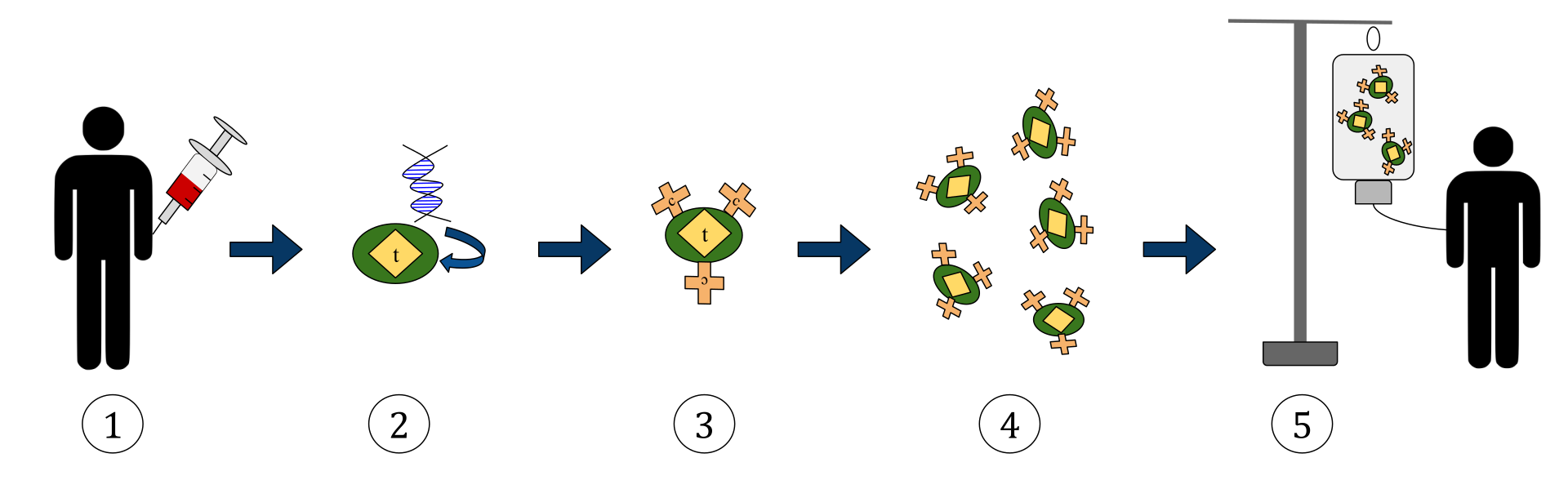
El diagrama anterior representa el proceso de la terapia con células T del receptor de antígeno quimérico (CAR). Este es un método de inmunoterapia, que es una práctica creciente en el tratamiento del cáncer. El resultado final debería ser una producción de células T equipadas que puedan reconocer y combatir las células cancerosas infectadas en el cuerpo.
1. Las células T (representadas por objetos etiquetados como ‘t’) se extraen de la sangre del paciente.
2. Luego, en un laboratorio, el gen que codifica los receptores de antígenos específicos se incorpora a las células T.
3. Produciendo así los receptores CAR (etiquetados como c) en la superficie de las células.
4. Las células T recién modificadas se cosechan y se cultivan en el laboratorio.
5. Después de un cierto período de tiempo, las células T diseñadas se vuelven a infundir al paciente.
Células T receptoras de antígeno quimérico (también conocido como Células T CAR) son células T que han sido modificadas genéticamente para producir un receptor de células T artificial para su uso en inmunoterapia.
Receptores de antígenos quiméricos (Carros, también conocido como inmunorreceptores quiméricos, receptores quiméricos de células T, o receptores de células T artificiales) son proteínas receptoras que han sido diseñadas para dar a las células T la nueva capacidad de dirigirse a una proteína específica. Los receptores son quiméricos porque combinan las funciones de unión al antígeno y de activación de las células T en un solo receptor.
La terapia con células CAR-T utiliza células T diseñadas con CAR para la terapia del cáncer. La premisa de la inmunoterapia CAR-T es modificar las células T para que reconozcan las células cancerosas con el fin de atacarlas y destruirlas de manera más eficaz. Los científicos extraen células T de las personas, las alteran genéticamente y luego infunden las células CAR-T resultantes en los pacientes para atacar sus tumores. Las células CAR-T pueden derivarse de las células T de la propia sangre del paciente (autólogas) o de las células T de otro donante sano (alogénicas). Una vez aisladas de una persona, estas células T se diseñan genéticamente para expresar un CAR específico, que las programa para que se dirijan a un antígeno que está presente en la superficie de los tumores. Por seguridad, las células CAR-T están diseñadas para ser específicas de un antígeno expresado en un tumor que no se expresa en células sanas.
Una vez que se infunden células CAR-T en un paciente, actúan como un “fármaco vivo” contra las células cancerosas. Cuando entran en contacto con su antígeno objetivo en una célula, las células CAR-T se unen a él y se activan, luego proceden a proliferar y se vuelven citotóxicas. Las células CAR-T destruyen las células a través de varios mecanismos, incluida la proliferación celular estimulada extensa, aumentando el grado en que son tóxicos para otras células vivas (citotoxicidad) y provocando el aumento de la secreción de factores que pueden afectar a otras células como citocinas, interleucinas y factores de crecimiento.
Producción de células CAR-T

El primer paso en la producción de células CAR-T es el aislamiento de las células T de la sangre humana. Las células CAR-T pueden fabricarse a partir de la propia sangre del paciente, conocida como tratamiento autólogo, o de la sangre de un donante sano, conocida como tratamiento alogénico. El proceso de fabricación es el mismo en ambos casos; solo la elección del donante de sangre inicial es diferente.
Primero, los leucocitos se aíslan usando un separador de células sanguíneas en un proceso conocido como aféresis de leucocitos. A continuación, se separan y recogen las células mononucleares de sangre periférica (PBMC). Los productos de la aféresis de leucocitos se transfieren luego a un centro de procesamiento de células. En el centro de procesamiento celular, se estimulan células T específicas para que proliferen activamente y se expandan en grandes cantidades. Para impulsar su expansión, las células T generalmente se tratan con la citocina interleucina 2 (IL-2) y anticuerpos anti-CD3.
Las células T expandidas se purifican y luego se transducen con un gen que codifica el CAR modificado mediante un vector retroviral, típicamente un gammaretrovirus integrador (RV) o un vector lentiviral (LV). Estos vectores son muy seguros en los tiempos modernos debido a una deleción parcial de la región U3. La nueva herramienta de edición de genes CRISPR / Cas9 se ha utilizado recientemente en lugar de vectores retrovirales para integrar el gen CAR en sitios específicos del genoma.
El paciente se somete a quimioterapia de linfodepleción antes de la introducción de las células CAR-T diseñadas. El agotamiento del número de leucocitos circulantes en el paciente regula al alza el número de citocinas que se producen y reduce la competencia por los recursos, lo que ayuda a promover la expansión de las células CAR-T diseñadas.
Aplicaciones clínicas
En marzo de 2019, se estaban llevando a cabo alrededor de 364 ensayos clínicos en todo el mundo con células CAR-T. La mayoría de esos ensayos se dirigen a los cánceres de la sangre: las terapias CAR-T representan más de la mitad de todos los ensayos de neoplasias hematológicas. CD19 sigue siendo el antígeno diana más popular, seguido de BCMA (comúnmente expresado en mieloma múltiple). En 2016, los estudios comenzaron a explorar la viabilidad de otros antígenos, como el CD20. Los ensayos para tumores sólidos están menos dominados por CAR-T, con aproximadamente la mitad de los ensayos basados en terapia celular que involucran otras plataformas como las células NK.
Cáncer
Las células T se diseñan genéticamente para expresar receptores de antígenos quiméricos dirigidos específicamente hacia los antígenos en las células tumorales de un paciente, luego se infunden en el paciente donde atacan y destruyen las células cancerosas. Las células T modificadas con CAR pueden diseñarse para dirigirse a prácticamente cualquier antígeno asociado a tumores.
Las primeras investigaciones sobre las células CAR-T se han centrado en los cánceres de la sangre. Los primeros tratamientos aprobados utilizan CAR que se dirigen al antígeno CD19, presente en cánceres derivados de células B, como la leucemia linfoblástica aguda (LLA) y el linfoma difuso de células B grandes (DLBCL). También se están realizando esfuerzos para diseñar CAR que se dirijan a muchos otros antígenos del cáncer de la sangre, incluido el CD30 en el linfoma de Hodgkin refractario; CD33, CD123 y FLT3 en leucemia mieloide aguda (AML); y BCMA en mieloma múltiple.
Los tumores sólidos han presentado un objetivo más difícil. La identificación de buenos antígenos ha sido un desafío: tales antígenos deben estar altamente expresados en la mayoría de las células cancerosas, pero en gran medida ausentes en los tejidos normales. Las células CAR-T tampoco se transportan de manera eficiente al centro de las masas tumorales sólidas, y el microambiente del tumor hostil suprime la actividad de las células T.
Enfermedad autoinmune
Si bien la mayoría de los estudios de células CAR T se centran en crear una célula CAR T que puede erradicar una determinada población de células (por ejemplo, células CAR T que se dirigen a las células del linfoma), existen otros usos potenciales para esta tecnología. Las células T también pueden proteger a los autoantígenos de reacciones autoinmunes. Una célula T reguladora equipada con un CAR podría tener el potencial de conferir tolerancia a un antígeno específico, algo que podría utilizarse en el trasplante de órganos o en enfermedades reumáticas como el lupus.
Satefy
Existen efectos secundarios graves que resultan de la introducción de células CAR-T en el cuerpo, incluido el síndrome de liberación de citocinas y la toxicidad neurológica. Debido a que es un tratamiento relativamente nuevo, hay pocos datos sobre los efectos a largo plazo de la terapia con células CAR-T. Todavía existen preocupaciones sobre la supervivencia a largo plazo de las pacientes, así como las complicaciones del embarazo en las pacientes tratadas con células CAR-T. La anafilaxia es un efecto secundario esperado, ya que el CAR se produce con un anticuerpo monoclonal extraño y, como resultado, provoca una respuesta inmune.
El reconocimiento dentro del objetivo / fuera del tumor se produce cuando la célula CAR-T reconoce el antígeno correcto, pero el antígeno se expresa en tejido sano no patógeno. Esto da como resultado que las células CAR-T ataquen tejido no tumoral, como las células B sanas que expresan CD19. La gravedad de este efecto adverso puede variar desde la aplasia de células B, que puede tratarse con infusiones de apoyo, hasta una toxicidad extrema que conduce a la muerte.
También existe la posibilidad poco probable de que las células CAR-T manipuladas se transformen ellas mismas en células cancerosas mediante mutagénesis de inserción, debido a que el vector viral inserta el gen CAR en un supresor de tumores u oncogén en el genoma de la célula T huésped. Algunos vectores retrovirales (RV) conllevan un riesgo menor que los vectores lentivirales (LV). Sin embargo, ambos tienen el potencial de ser oncogénicos. Se ha establecido el análisis de secuenciación genómica de los sitios de inserción de CAR en las células T para comprender mejor la función y la persistencia de las células T con CAR in vivo.
Síndrome de liberación de citocinas
El problema más común después del tratamiento con células CAR-T es el síndrome de liberación de citocinas (SRC), una afección en la que el sistema inmunológico se activa y libera una mayor cantidad de citocinas inflamatorias. La manifestación clínica de este síndrome se asemeja a la sepsis con fiebre alta, fatiga, mialgia, náuseas, fugas capilares, taquicardia y otras disfunciones cardíacas, insuficiencia hepática e insuficiencia renal. El SRC ocurre en casi todos los pacientes tratados con terapia con células CAR-T; de hecho, la presencia de CRS es un marcador de diagnóstico que indica que las células CAR-T están funcionando según lo previsto para destruir las células cancerosas. Sin embargo, tenga en cuenta que un grado más alto de gravedad del SRC no se correlaciona con una mayor respuesta al tratamiento, sino con una mayor carga de enfermedad.
Neurotoxicidad asociada a células efectoras inmunes
La toxicidad neurológica también se asocia a menudo con el tratamiento con células CAR-T. El mecanismo subyacente es poco conocido y puede estar relacionado o no con el SRC. Las manifestaciones clínicas incluyen delirio, pérdida parcial de la capacidad de hablar coherentemente sin dejar de tener la capacidad de interpretar el lenguaje (afasia expresiva), disminución del estado de alerta (obnubilación) y convulsiones. Durante algunos ensayos clínicos se han producido muertes causadas por neurotoxicidad. La principal causa de muerte por neurotoxicidad es el edema cerebral. En un estudio realizado por Juno Therapeutics, Inc., cinco pacientes inscritos en el ensayo murieron como resultado de un edema cerebral. Dos de los pacientes fueron tratados con ciclofosfamida sola y los tres restantes fueron tratados con una combinación de ciclofosfamida y fludarabina. En otro ensayo clínico patrocinado por el Centro de Investigación del Cáncer Fred Hutchinson, se informó de un caso de toxicidad neurológica irreversible y fatal 122 días después de la administración de células CAR-T.
.


:max_bytes(150000):strip_icc()/GettyImages-498528146-a5b5f593f02043ab9610d6e357e6dab3.jpg)